Quand un seul gène change votre mode vie : l’étonnante flexibilité de Escherichia coli
L’utilisation à grande échelle de l’antibiotique Colistine a conduit à l'identification du premier gène de résistance plasmidique chez des Escherichia coli en 2015. Ce gène mcr-1 modifie le lipopolysaccharide de la paroi bactérienne, qui est à la fois la cible de la colistine et l’organe senseur des bactéries pour interagir avec l’environnement. Dans ce travail, nous avons explorer l’impact de l’acquisition de ces gènes mcr sur le comportement de E. coli dans l’environnement intestinal et sa virulence. Il émerge des résultats un nouveau paradigme où l’acquisition d’un gène favorise l’implantation et la persistance dans le microbiote intestinal via (i) l’adhésion au mucus et aux cellules épithéliales intestinales, (ii) la résistance aux défensines de l’intestin, et (iii) une activité ? peacekeeper ? vis-à-vis du système immunitaire.
L'antibiotique colistine a été réintroduit ces dernières années en tant qu'antibiotique de "dernier recours". Son utilisation à grande échelle a conduit à l'identification du premier gène de résistance plasmidique ; mcr-1 chez des Escherichia coli multirésistants en Chine en 2015. Depuis, 10 gènes mcr et des variantes ponctuelles ont été identifiés dans le monde entier, y compris en France au Centre National de Référence de la résistance aux antibiotiques que nous coordonnons.
Présent sur un large éventail de plasmides, les gènes mcr ont été observés dans des bactéries sensibles aux antibiotiques et dans des plasmides ne contenant aucun autre gène de résistance connu, alors que les gènes de résistance aux antibiotiques sont généralement regroupés dans des plasmides dédiés. Ainsi, des E. coli portant un gène mcr ont été observés dans le tube digestif d'humains, d'animaux domestiques, d'animaux destinés à l'alimentation et d'oiseaux migrateurs. Ces gènes modifient le lipopolysaccharide de la paroi bactérienne, qui est la cible de la colistine mais aussi l’organe senseur des bactéries pour interagir avec l’environnement. Il pourrait donc avoir des r?les autres que la résistance aux antibiotiques.
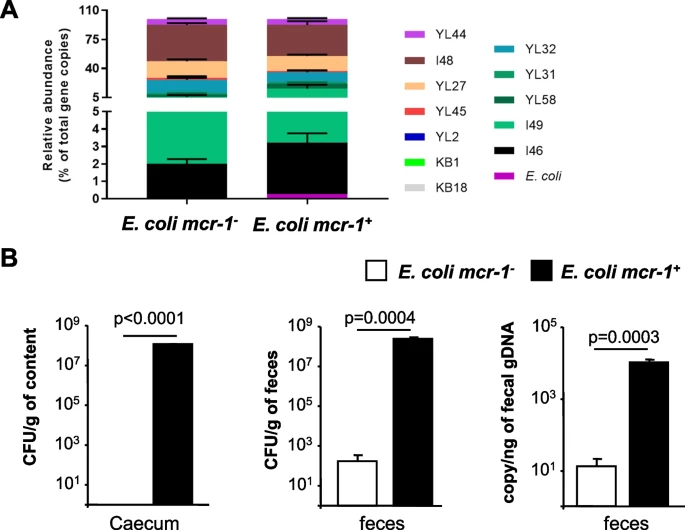
Dans cette étude, nous avons étudié la capacité des E. coli porteurs de mcr-1 à coloniser l'intestin en absence d’antibiotique. Dans des modèles murins gnotobiotiques et conventionnelles, mcr-1 augmentait l'ancrage et la persistance intestinal de E. coli et abrogé sa virulence. Cette colonisation intestinale était associée à une diminution des marqueurs de l’inflammation intestinale et à la préservation de la composition du microbiote intestinal en abondance et en diversité. Ces observations s’expliquaient par des effets multiples ; (i) une résistance croisée aux antimicrobiens sécrétés par le microbiote et aux défensines produites par les cellules épithéliales intestinales (CEI), (ii) l’adhésion au mucus intestinal et aux cellules intestinales épithéliales et (iii) une diminution de l’activité pro-inflammatoire de E. coli et de son lipopolysaccharide. Ces propriétés étaient également retrouvées avec 4 autres gènes mcr représentatifs et étaient dépendantes de l’intégrité du site actif des protéines Mcr.
A l’aide d’une méthode de modélisation tridimensionnelle, des homologues distants des gènes mcr ont été recherchés dans les données métagénomiques du microbiote intestinal humain. Ces homologues se sont avérés conservés et abondants mais cette abondance était amoindrie chez les patients atteints de maladies inflammatoires chroniques intestinales, suggérant un r?le fonctionnel des gènes de type mcr pour l’h?te au sein du microbiote intestinal.
Ainsi, nous avons constaté que les gènes mcr affectent de multiples facettes des interactions h?te-bactérie pour favoriser l’infiltration discret de E. coli dans le microbiote intestinal au détriment de sa virulence. Ils favorisent un mode de vie comparable à celui des commensaux majeurs de l’intestin, laissant présager une persistance durable des gènes mcr même en absence d’antibiotique. Ces travaux remettent ainsi en cause le développement d’antibiotiques basés sur le mode d’action des défensines et de la colistine, mais ouvrent également une voie pour le traitement des maladies inflammatoires chroniques de l’intestin gr?ce à l’activité antiinflammatoire de ces gènes.
Référence de la publication : Dalmasso G, Beyrouthy R, Brugiroux S, Ruppé E, Guillouard L, Bonnin V, Saint-Sardos P, Ghozlane A, Gaumet V, Barnich N, Delmas J, Bonnet R. Genes mcr improve the intestinal fitness of pathogenic E. coli and balance their lifestyle to commensalism. Microbiome. 2023; an 20;11(1):12. doi: 10.1186/s40168-022-01457-y.
Pour plus d'informations : https://microbiomejournal.biomedcentral.com/articles/10.1186/s40168-022-01457-y
https://www.youtube.com/watch?v=7aZHnQeso04
Coordonnées: Guillaume Dalmasso & Richard Bonnet, M2ISH, Inserm U1071, uscINRAE 2018, Université Clermont Auvergne, CRBC, 28 Place Henri Dunant 63000 Clermont-Ferrand.
e-mail : guillaume.dalmasso@uca.fr; rbonnet@chu-clermontferrand.fr
tel : 04 73 751 920
